原标题:再下一城: 免疫+靶向“双杀"新疗法获批, 患者又添抗癌利器!
时隔一周,肿瘤免疫治疗领域再传捷报。
5月14日,美国食品药物管理局(FDA)火速批准PD-L1抗体Avelumab(A药)和阿昔替尼的联合疗法上市,临床数据显示:
针对晚期肾癌患者:使用A药+阿昔替尼的联合疗法,有 效率高达51.4%,无进展生存期13.8个月;而使用传统疗法舒尼替尼,有 效率只有25.7%,无进展生存期8.4个月。
也就是说,联合疗法提高了一倍的有 效率,降低了39%的疾病死亡或者进展风险。毫无疑问,对肾癌患者来说,免疫联合疗法是更好的选择。
这是继4月19日FDA批准首 个免疫+靶向联合疗法之后,第二个获批的免疫+靶向联合疗法,适应症都是肾癌一 线治疗。不同之处在于,上次是PD-1单抗Keytruda+阿昔替尼,这次是PD-L1单抗Avelumab+阿昔替尼。
对癌症患者来说,这是个好消息:明星抗癌药PD-1/PD-L1抗体找到了同一个搭档-阿昔替尼,可以大幅度提高有 效率。不仅如此,该联合疗法的获批,也会激励药厂进行更多的免疫联合疗法的尝试,给更多癌症患者带来更有 效的治疗策略。
下面,我们来详细分析一下A药+阿昔替尼的临床数据
临床设计:在该研究中,研究人员招募了861名晚期肾癌患者,按照1:1的方式随机分配患者,联合治疗组有442名患者,他们会接受每两周一次的PD-L1(10mg/kg)+每天2次的阿昔替尼(5mg)联合治疗,对比组则有444人,会使用舒尼替尼进行治疗。
临床数据:
有 效率方面:舒尼替尼客观缓解率(ORR)只有25.7%,而经过PD-L1+阿昔替尼联合疗法治疗后的患者,有3例出现了完全反应(CRs),还有48例出现了部分反应(PRs),30例为稳定病(SD),12例为进展病(PD),客观缓解率(ORR)也提升了一半,高达51.4%,效 果远高于舒尼替尼。具体如下图:

无进展生存期方面:舒尼替尼无进展生存期(PFS)中位数为8.4个月,PD-L1+阿昔替尼联合疗法的(PFS)中位数则高达13.8个月。经过19个月的随访,接受PD-L1+阿昔替尼联合治疗的患者,PD-L1表达为阳性的人群客观缓解率(ORR)翻了1倍多,从25.5%提高到了55.2%,疾病进展/死亡风险降低了39%。具体如下:
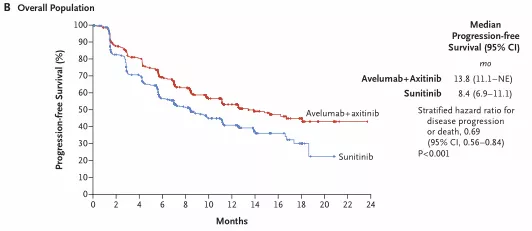
副作用方面:两种疗法的差别并不大,接受免疫+靶向联合疗法的患者有71.2%出现3级以上的副作用,使用舒尼替尼治疗的患者中有71.5%的患者出现3级以上的副作用。在治疗的过程中,分别有22.8%和13.4%的患者中断了治疗。
也就是说,相比于肾癌一 线标准疗法舒尼替尼,PD-L1抗体Avelumab+阿昔替尼提高了一倍的有 效率(51.4% VS 25.7%),降低了39%的疾病进展或者死亡风险(13.8月 VS 8.4月)。
对于肾癌来说,目前FDA已经批准了PD-1抗体K药+阿昔替尼和O药+伊匹单抗两种疗法用于肾癌的一 线治疗,同时FDA还授予PD-1抗体K药+仑伐替尼“突破性药物”资格(有 效率70%),而之前肾癌的标准疗法舒尼替尼已经被“拍死在沙滩上”了。
两款免疫联合治疗方案的相继获批,不但让肾癌成为最早受益于免疫+靶向联合疗法的癌症类型,还让患者有了更多选择,而且进一步拓展了免疫+靶向联合疗法的路径。
可以说,免疫+靶向的联合疗法正在成为癌症治疗的新方向和新希望,期待未来免疫+靶向联合疗法能有更多的突破,更好地造福广大癌症患者。
参考资料
1.https://www.onclive.com/web-exclusives/fda-approves-frontline-avelumabaxitinib-for-frontline-rcc
2. Avelumab plus Axitinib versus Sunitinib forAdvanced Renal-Cell Carcinoma. N Engl J Med. 2019 Mar 21;380(12):1103-1115.
来源: 咚咚癌友圈 原创: 咚咚医学部
本文为转载,我们不对其内容和观点负责。

