最新的国家政策,给印度仿制药进入中国创造了更便利的条件。
7月10日,国家药品监督管理局发布了《接受药品境外临床试验数据的技术指导原则》,认可创新药的境内外同步研发在境外获得的临床试验数据,以及具备完整可评价的生物等效性数据的在境外开展仿制药研发数据。
国家药监局认可的境外临床试验数据的评判标准包括境外临床试验数据真实性、完整性、准确性、可溯源性,有效性和安全性,人种差异研究。
对于用于危重疾病、罕见病、儿科且缺乏有效治疗手段的药品注册申请,经评估其境外临床试验数据属于“部分接受”情形的,可采用有条件接受临床试验数据方式,在药品上市后收集进一步的有效性和安全性数据用于评价。
这其实是两个月前另一个政策的补充――5月23日,国家药监局、国家卫健委联合发布了《关于优化药品注册审评审批有关事宜的公告》,提到对于境外已上市的防治严重危及生命且尚无有效治疗手段疾病以及罕见病药品,进口药品注册申请人经研究认为不存在人种差异的,可以提交境外取得的临床试验数据直接申报药品上市注册申请。
对于本公告发布前已受理并提出减免临床试验的上述进口药品临床试验申请,符合《药品注册管理办法》及相关文件要求的,可以直接批准进口。
这两大政策的出台,业界认为这是放开进口注册5.2类的标志,特别是多年没有获批的号称价格低廉的印度仿制药将有望获批。
▍这意味着以下类别的药品可能会在本次政策中获益:
创新药,Ⅲ期临床试验包括东亚人种特别是中国亚组的研究。
进口仿制药/国内共线生产仿制药,原研药做了上述的东亚人种特别是中国亚组的研究。
临床必需药,如危重疾病、罕见病、儿科且缺乏有效治疗手段的药品可适当放松标准,但是上市后仍需要收集进一步的有效性和安全性数据用于上市后再评价。
这意味着进口仿制药对应的原研厂家在中国或日本已经上市的产品才有可能在政策上获益。引进这类进口仿制药影响最大的是过期原研药品,进口仿制药将有可能进一步推动过期原研药品的降价。
▍进口仿制药:印度申报最多
咸达药海遨游整理了2016年以来申报5.2类进口即进口仿制药的产品名单发现,申报产品最多的国家和地区首位是印度,其次是瑞士,再次是台湾和希腊。
申报产品最多的企业为印度瑞迪博士,申报产品包括地拉罗司分散片、醋酸阿比特龙片、氟维司群注射液、枸橼酸西地那非口崩片、利伐沙班片和碳酸司维拉姆片。其次是诺华/山德士,申报产品包括草酸艾司西酞普兰片、伏立康唑片、糠酸莫米松鼻喷雾剂、沙美特罗替卡松粉吸入剂和左乙拉西坦片。
不少国内厂家参与了5.2类进口药引进的项目,例如江苏先声与Celon Pharma S.A.合作,华润九新和法默森合作,兆科和BioQ Pharma Limited 、HOLOPACK Verpackungstechnik GmbH的合作,广州汉光和Pharmanel Commercial Pharmaceutical S.A.的合作。
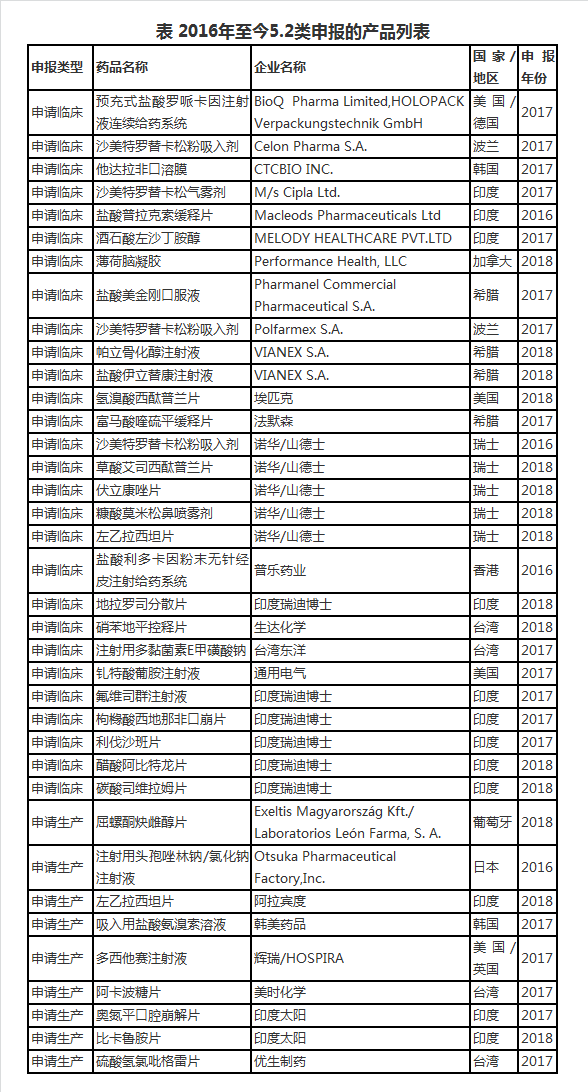
数据来源:咸达药海遨游
▍小结
中国加入ICH后,进口仿制药获批加快是意料之事,但是目前境外临床数据互认还在摸索之中,境外临床数据需要补充哪些试验的标准仍未确立,短期内大量获批的可能性比较低。
长期而言,若进口仿制药符合国内一致性评价标准,价格低廉,对国内仿制药生产厂家必然会引起冲击。
仿制药企业的竞争将会进入成本竞争,国内企业必须从产品立项、原料药和辅料供应、生产效率、销售覆盖能力等多方面综合考虑应对措施。
来源:赛柏蓝 特约撰稿:阿托品
本文为转载,我们不对其内容和观点负责。

