2021年7月12日,国家药品监督管理局(NMPA)药品审评中心(CDE)正式受理武田制药提交的肺癌领域一类创新药物Mobocertinib(TAK-788)上市许可申请(NDA),并获准纳入优先审评审批程序。
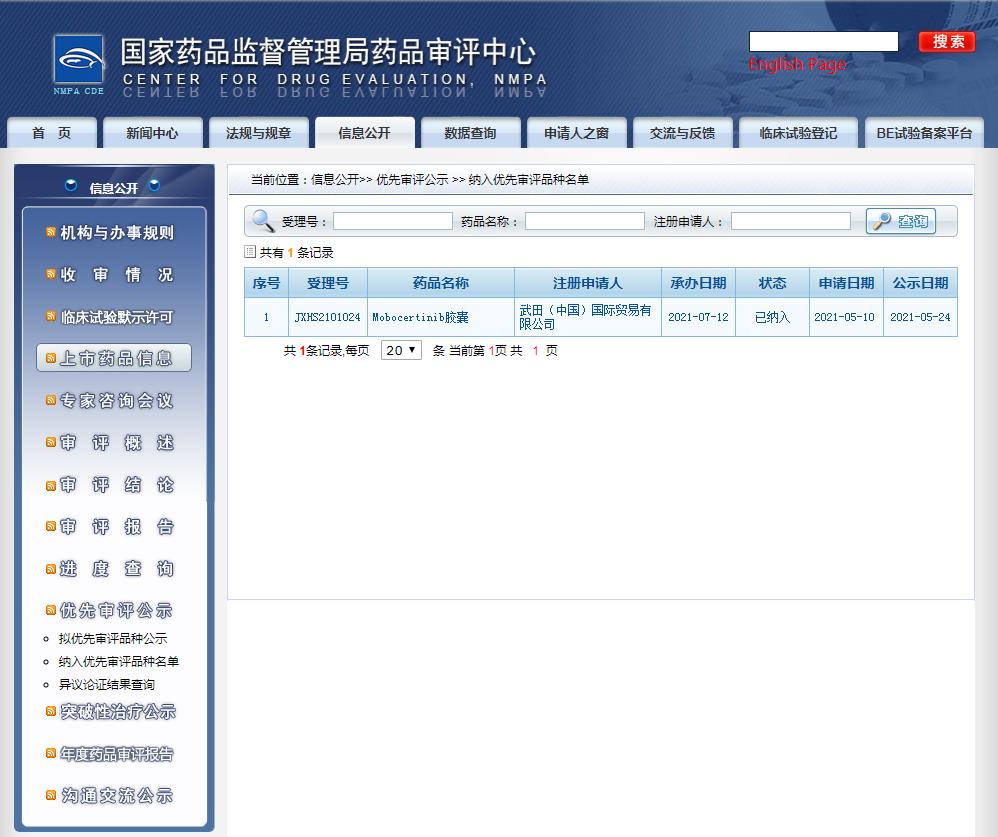
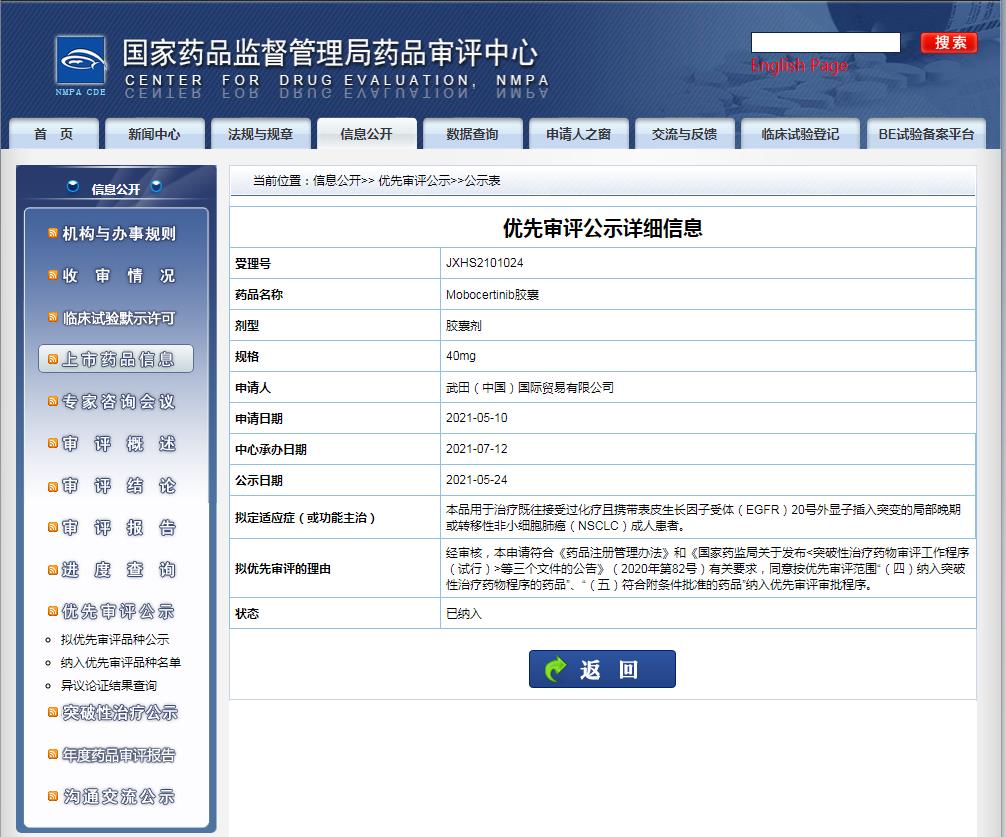
图片来源:CDE官网
拟定适应症为:用于治疗携带表皮生长因子受体(EGFR)20号外显子插入突变的非小细胞肺癌(NSCLC)成人患者。
据悉,在2019年12月,美国食品药品监督管理局(FDA)授予Mobocertinib孤儿药认定;在2020年4月,获得美国食品药品监督管理局(简称“FDA”)突破性疗法认定[1]。在今年的4月,美国FDA已授予Mobocertinib优先审评资格,或许有可能会实现中国与全球的同步批准。值得一提的是,美国FDA于5月21日加速批准Amivantamab上市,用于治疗正在接受或接受过含铂化疗后进展的局部晚期或转移性Exon 20插入突变的成人NSCLC患者。
关于EGFR 20号外显子插入突变
据世界卫生组织(WHO)统计,全球每年新发肺癌病例约为180万,其中非小细胞肺癌(NSCLC)大概占85%左右。
EGFR 20号外显子插入突变是非小细胞肺癌(NSCLC)中发现的一种突变,在东亚地区,在50%的肺腺癌患者中发现了EGFR激活突变。
肺癌病人EGFR突变,主要有四种类型,分别为外显子19缺失突变,外显子21点突变,外显子18点突变和外显子20插入突变,其中比较常见的EGFR突变是外显子19缺失和外显子21突变,二者常常被认为是“经典”EGFR 激活突变。
EGFR外显子20插入(exon 20)突变在分子水平上存在异质性,文献数据显示[2],在非小细胞肺癌 EGFR突变患者中,EGFR外显子20插入突变的比例约为4%~10%。在国内的所有非小细胞肺癌中,EGFR 20号外显子插入突变发生率约占2.3%[3]。
目前,对于EGFR 20号外显子插入突变的非小细胞肺癌病人来说,长期容易受到疾病的困扰,此外,查询NMPA官网,现在还没有针对EGFR 20号外显子插入突变的药物获批上市,所以治疗的选择十分有限,患者也因此存在未尽的治疗需求。
祝贺CDE受理mobocertinib的上市许可申请,这将有望使这些患者能够更早地获益于此创新疗法,惠及患者。
参考文献:
[1] https://www.onclive.com/view/fda-grants-mobocertinib-breakthrough-designation-for-egfr-exon-20mutant-nsclc
[2] 1. Vyse and Huang. Targeting EGFR exon 20insertion mutations in NSCLC. Signal Transduction and Targeted Therapy (2019)4:5
[3] Zhefeng Liu, Lin Wu, Jun Cao, et al. Clinical characterization of ERBB2 exon 20 insertions and heterogeneity of outcomes responding to afatinib in Chinese lung cancer patients . Onco targets and therapy
订购需求
- *联系人
- *联系电话
- *咨询品种
- 特殊备注
如紧急,请拨打
400-168-0606电话咨询。









